Revisión de la prueba de eficacia de los desinfectantes - La importancia del tiempo de contacto húmedo

Introducción
El uso de desinfectantes como agentes encargados del control de la contaminación microbiológica de un entorno está muy extendido y su gestión corre a cargo de organismos reguladores, tanto en Europa como en Estados Unidos.
El Reglamento de Productos Biocidas (BPR, por sus siglas en inglés) 528/2012 [1] regula la comercialización y el uso de productos biocidas en Europa. Los desinfectantes químicos de estados Unidos están registrados y regulados por la Agencia de Protección Ambiental de EE. UU. (EPA) en base a la ley federal de Insecticidas, Fungicidas y Rodenticidas (FIFRA, por sus siglas en inglés) (40 CFR, partes 150-189). [2] Según la FIFRA, los desinfectantes químicos se consideran "pesticidas antimicrobianos".
Tanto el BPR como la EPA piden datos que demuestren la eficacia de un desinfectante, ya sea bactericida, fungicida, esporicida o viricida como requisito indispensable para que los proveedores registren el producto.
Estas regulaciones también obligan a los usuarios finales de los desinfectantes que trabajen en el sector farmacéutico a demostrar la eficacia del desinfectante. Las indicaciones de la Administración de Medicamentos y Alimentos de EE. UU. (FDA, por sus siglas en inglés) para la industria farmacéutica afirman que "es necesario evaluar la adecuación, la eficacia y las limitaciones de los agentes desinfectantes y procedimientos. La efectividad de estos procedimientos y desinfectantes debe medirse en base a su capacidad para garantizar la eliminación de posibles agentes contaminantes de las superficies". [3] En Europa, la Comisión Europea impone unos requisitos similares: "4.37 Se debe validar el proceso de desinfección. Los estudios de validación deberían demostrar la adecuación y la eficacia de los desinfectantes en la forma específica en la que se han utilizado. Además, deben brindar respaldo a las soluciones preparadas que estén próximas a su fecha de caducidad". [4]
Métodos para demostrar la eficacia
En Europa, la Norma Europea (EN) 14885:2018 [5] proporciona referencias sobre los métodos de prueba (normas EN) que deben llevar a cabo los fabricantes de productos desinfectantes para apoyar las pretensiones de la actividad microbicida. En Estados Unidos, la Guía sobre Pruebas de Desempeño de Productos (o Product Performance Test Guideline) OCSPP 810.2100 de la EPA [6] especifica los métodos de prueba (establecidos por la asociación de químicos analíticos oficiales, AOAC) que deben llevar a cabo los fabricantes de productos desinfectantes para apoyar las pretensiones de la actividad microbicida.
Las pruebas se dividen en dos categorías:
- Prueba de suspensión
Por ej. EN 1276 Antisépticos y desinfectantes químicos. Ensayo cuantitativo de suspensión para la evaluación de la actividad bactericida de los antisépticos y desinfectantes químicos utilizados en el área alimentaria, industrial, doméstica e institucional. Método de ensayo y requisitos (fase 2, etapa 1).
EN 1650 Antisépticos y desinfectantes químicos. Ensayo cuantitativo de suspensión para la evaluación de la actividad fungicida de los antisépticos y desinfectantes químicos utilizados en el área alimentaria, industrial, doméstica e institucional. Método de ensayo y requisitos (fase 2, etapa 1).
Método oficial de la AOAC 955.15 Método de la dilución de uso para probar los desinfectantes frente al Staphylococcus Aureus.
- Prueba de superficie
Por ej. EN 13697 Antisépticos y desinfectantes químicos. Ensayo cuantitativo de superficie no porosa para la evaluación de la actividad bactericida y/o fungicida de los desinfectantes químicos utilizados en productos alimenticios, en la industria, en el hogar y en colectividad. Método de ensayo sin acción mecánica y requisitos (fase 2, etapa 2).
Método oficial de la AOAC 961.02 para productos germicidas en spray como los desinfectantes.
Los distintos tipos de pruebas emplean inóculos iniciales, organismos, reducciones logarítmicas y tiempos de contacto específicos.
Para registrar un desinfectante en Europa, los fabricantes suelen realizar pruebas EN, cuyos números a menudo aparecen indicados en las etiquetas de los productos junto con los tiempos de contacto estándar específicos para cada método. Normalmente se utilizan métodos de prueba estándar debido a que son fiables y reproducibles y están bien organizados. Además, pueden resultar útiles si los usuarios finales desean consultar los resultados de la prueba y comparar productos de distintos fabricantes.
Es posible que los métodos de prueba estándar no reflejen de forma precisa las condiciones del entorno antiséptico de los usuarios finales del desinfectante procedentes del sector farmacéutico. Normalmente, los usuarios finales disponen de superficies de distintos materiales, diversos tipos de microorganismos y condiciones ambientales diferentes (como poca humedad o secado rápido debido a la acción de los sistemas HVAC).
El capítulo <1072> de la Farmacopea de Estados Unidos (USP, por sus siglas en inglés) [7] ofrece más información sobre las pruebas de eficacia para el sector farmacéutico, y afirma que "para demostrar la eficacia de un desinfectante en un entorno de fabricación de productos farmacéuticos, es posible que sea necesario llevar a cabo las siguientes pruebas: (1) pruebas de dilución (clasificar los desinfectantes según su eficacia frente a diferentes concentraciones de microorganismos de prueba estándar y aislados ambientales y a los periodos de contacto con los mismos); (2) Pruebas de desinfectantes sobre superficies (se emplean microorganismos de prueba estándar y aislados ambientales típicos, se aplican los desinfectantes a las superficies en las concentraciones especificadas y durante el tiempo de contacto determinado, y se comprueba la reducción logarítmica de dichos microorganismos); y (3) una comparación estadística de la frecuencia de aislamiento de los microorganismos aislados antes y después de la implementación de un nuevo desinfectante.
Esto se considera necesario debido a que algunas etapas clave del proceso deben ser validadas, como la desinfección de áreas de procesamiento asépticas según las BPM, y a que los requisitos de registro de la EPA no contemplan el modo en el que se utilizan los desinfectantes en las industrias farmacéutica, biotecnológica y médica.
De acuerdo a lo estipulado por la USP, es relativamente fácil utilizar diferentes tipos de microorganismos y superficies para las pruebas estándar. Sin embargo, alcanzar los periodos de contacto especificados para los métodos de prueba estándar puede resultar complicado en las condiciones ambientales de los ambientes asépticos de la industria farmacéutica. La tasa de evaporación de un desinfectante aplicado con un paño sobre una superficie de un ambiente aséptico con un índice de renovación de aire alto puede resultar significativamente diferente en las condiciones propias de un laboratorio. Esto puede generar dudas sobre si la superficie debe estar visiblemente humedecida por el desinfectante durante el periodo de tiempo especificado para conseguir el máximo nivel de eficacia y, consecuentemente, sobre cómo de largo debe ser exactamente ese periodo de tiempo.
Definiciones del periodo de contacto
Para establecer si el hecho de que las superficies permanezcan visiblemente humedecidas durante el tiempo de contacto especificado (de ahora en adelante, "tiempo de contacto húmedo") debe ser considerado un requisito reglamentario para el sector farmacéutico, se llevó a cabo una revisión de las regulaciones.
En las referencias US [3],[8], las BPM de la UE [4] y el Convenio de Inspección Farmacéutica para la Cooperación (o Pharmaceutical Inspection Co-operation Scheme) [9] no aparece definido el "tiempo de contacto". La Farmacopea Europea (EP, por sus siglas en inglés)) no contempla indicaciones para pruebas de eficacia de los desinfectantes. Por su parte, el capítulo 1072 de la USP [7] emplea el término "tiempo de contacto" con frecuencia, si bien es cierto que no detalla su significado en el apartado de definiciones correspondiente. La norma ISO para salas blancas (ISO 14644, parte 5 [10]) tampoco establece ninguna definición.
Dado que las regulaciones del sector farmacéutico no ofrecen un significado claro, se realizó una búsqueda más amplia en otros documentos reglamentarios aplicables y reconocidos por la industria farmacéutica.
La Royal Pharmaceutical Society/NHS Pharmaceutical Quality Assurance Committee ofrece indicaciones sobre la aplicación de desinfectantes y establece que "se debe evitar la aplicación de cantidades excesivas de agentes limpiadores y desinfectantes. Idealmente, las superficies deberían secarse transcurridas 1 hora desde su aplicación. Sin embargo, también debería estar presente una cantidad de producto adecuada para alcanzar el nivel de eficacia deseado durante el tiempo de contacto recomendado (es decir, no se debe aplicar una capa de desinfectante demasiado fina)". [11] Esta afirmación sugiere que debería existir un tiempo de contacto húmedo para alcanzar un buen nivel de eficacia.
En los métodos EN y AOAC no se especifica ningún "tiempo de contacto húmedo". En las pruebas de suspensión, siempre se emplea un "tiempo de contacto húmedo", ya que la prueba requiere la adición del producto desinfectante a una suspensión de organismos en una solución durante el tiempo de contacto requerido, así como la agregación de un neutralizador una vez finalizado dicho tiempo de contacto.
Sin embargo, no está tan claro en el caso de las pruebas de superficie ya que, según la normativa, se debe aplicar una cantidad de desinfectante con una pipeta sobre la superficie sin extenderla. Debido a que la cantidad aplicada es muy reducida y a que la tensión superficial de muchos de los desinfectantes probados es relativamente alta, es posible que se consiga un tiempo de contacto húmedo en las condiciones del laboratorio.
La prueba de superficie EN 16615 [12] con acción mecánica ofrece un método que se aproxima más al uso práctico de los desinfectantes, ya que contempla el uso de toallitas para aplicar el desinfectante sobre la superficie. En la sección de "Condiciones experimentales" aparece esta información respecto al tiempo de contacto: "los tiempos de contacto para los desinfectantes de superficie se deciden en función de las condiciones prácticas del producto. Es responsabilidad del fabricante establecer el tiempo de contacto recomendado para utilizar el producto". Del término "condiciones prácticas del producto" se puede deducir que hace referencia a los volúmenes aplicados con el uso de paños o toallitas y a las tasas de evaporación, como en el caso de la comparación entre un alcohol y un compuesto de amonio cuaternario. De todas formas, sigue sin tratarse de una definición clara.
La sección 3.3.4 de la monografía técnica n.º 20 de la Pharmaceutical and Healthcare Sciences Society (PHSS) contiene la siguiente información: "las muestras se exponen al desinfectante durante el tiempo de contacto húmedo definido". [13] Esta afirmación habla claramente de un tiempo de contacto húmedo.
El Centro para el Control y la Prevención de Enfermedades de EE. UU. (CDC, por sus siglas en inglés) [14] contiene un glosario con la siguiente definición de tiempo de contacto: "el tiempo que el desinfectante está en contacto directo con la superficie o el objeto que debe ser desinfectado. Para la desinfección de superficies, este periodo abarca desde la aplicación sobre la superficie hasta el momento en el que el producto se haya secado por completo". En esta definición también se habla de forma clara de un tiempo de contacto húmedo.
La guía para pruebas de desempeño de productos OCSPP 810.2000 [15] incluye la siguiente información sobre el tiempo de contacto: "el tiempo de contacto empleado en las pruebas de eficacia debería ser igual o menor al que aparece definido en la etiqueta del producto. Si el tiempo de contacto se encuentra fuera del rango establecido en el método de prueba o en las indicaciones, es recomendable consultar con la agencia antes de realizar la prueba. Además, es posible que se deba modificar el enfoque inicial de la misma. En la mayoría de los casos, las modificaciones para obtener un tiempo de exposición más prolongado se ven limitadas debido a las consideraciones prácticas de los patrones de uso (por ej. un tiempo de exposición de >10 minutos para un producto que es probable que se haya evaporado de la superfcie pasados 10 minutos). Se deben identificar y justificar todas las modificaciones realizadas en el protocolo de prueba. Para los productos líquidos o en spray que contengan ingredientes activos volátiles y que se apliquen a superficies rígidas no porosas, el tiempo de contacto máximo se determinará en función de la inspección visual de la evaporación durante el tiempo de contacto propuesto". De nuevo, esta afirmación indica claramente la previsión de un tiempo de contacto húmedo.
El informe técnico n.º 70 de la PDA [16] incluye un glosario con la siguiente definición: "el tiempo mínimo que un desinfectante, producto antiséptico o esporicida debe permanecer en contacto (húmedo) completo con la superficie a tratar para resultar efectivo". En esta definición se habla claramente de un tiempo de contacto húmedo.
La guía para el uso de desinfectantes de Pharmig [17] incluye el siguiente texto: "es posible que se produzca una evaporación más rápida del desinfectante en las superficies cálidas o cuando la superficie tratada está sujeta a condiciones de baja humedad o flujo de aire elevado, tal y como ocurre en ocasiones en las salas blancas". Esta afirmación sugiere que debería existir un tiempo de contacto húmedo para alcanzar un buen nivel de eficacia.
En la revisión de publicaciones respaldadas por la industria farmacéutica llevada a cabo, queda más clara la necesidad de que el tiempo de contacto sea húmedo.
No resulta para nada impensable que la eficacia del desinfectante continúe haciendo efecto una vez que la superficie esté visiblemente seca, ya que estará actuando a nivel celular. La primera fase de la eliminación microbiana es la absorción del ingrediente activo del desinfectante por parte de la célula. Por tanto, se puede considerar que durante la desinfección entran en juego dos "periodos" (imagen 1).
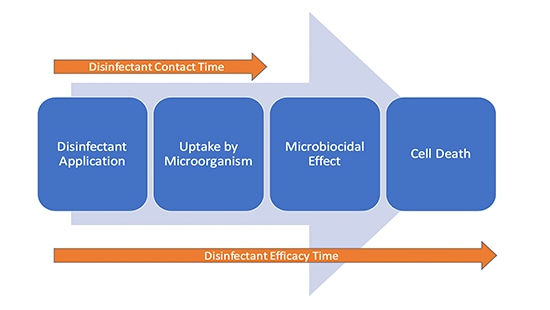
Conclusión
Para demostrar la eficacia de un desinfectante, el fabricante debe llevar a cabo pruebas estándar en condiciones repetibles, a partir de las cuales se definirá el tiempo de contacto. Este tiempo de contacto deberá servir para ayudar al usuario final a seleccionar el desinfectante que mejor se adapte a sus necesidades.
Asimismo, el usuario final debe validar la eficacia del desinfectante. Para ello, ha de reflejar el uso que se ha hecho del mismo en sus instalaciones, así como el tiempo de contacto empleado.
En la mayoría de organizaciones con guías farmacéuticas se define el tiempo de contacto como tiempo de contacto húmedo.
Los estudios publicados que investigan el desempeño del desinfectante una vez que las superficies están visiblemente secas son limitados. Además, resulta imposible medirlo en la práctica, ya que el usuario no puede observar la erradicación celular como resultado.
Para facilitar al usuario final la realización de pruebas que sean representativas para las condiciones de sus instalaciones, se recomienda medir el tiempo que tardan en evaporarse los desinfectantes aplicados con técnicas rutinarias (con un paño o toallita) y usar dicho tiempo de contacto como referencia para los estudios llevados a cabo en su laboratorio.
Referencias:
- Reglamento (UE) n.º 528/2012 del Parlamento Europeo y del Consejo, de 22 de mayo de 2012, relativo a la comercialización y el uso de los biocidas
- Title 40 of the Code of Federal Regulations (Título 40 del Código de Reglamentos Federales) (40 CFR) Subchapter E Pesticide Programs Parts 150-189
- FDA Guidance for Industry (Información para la Industria de la FDA) - Sterile Drug Products Produced by Aseptic Processing, Current Good Manufacturing Practice (2004)
- EudraLex Volume 4 EU Guidelines to Good Manufacturing Practice (Guía de Buenas Prácticas de frabricación, GMP) Medicinal Products for Human and Veterinary Use Annex 1 Manufacture of Sterile Medicinal Products (borrador 12, publicado en febrero de 2020)
- EN 14885:2018 Antisépticos y desinfectantes químicos. Aplicación de normas europeas para los antisépticos y desinfectantes químicos
- EPA Product Performance Test Guideline, OCSPP 810.2100, Sterilants, Sporicides, and Decontaminants, Guidance for Efficacy Testing, [EPA 712-C-17-003]
- Farmacopea de Estados Unidos (USP), capítulo 1072 Desinfectantes y antisépticos
- Código de Reglamentos Federales (CFR), título 21 - Administración de Alimentos y Medicamentos: partes 1 a 1499
- PICS GUIDE TO GOOD MANUFACTURING PRACTICE FOR MEDICINAL PRODUCTS ANNEXES PE 009-14
- ISO 14644 parte 5 Salas limpias y locales anexos controlados - Parte 5: Funcionamiento, 2004
- Royal Pharmaceutical Society. Quality Assurance of Aseptic Preparation Services: Standards. Parte A, 5ª edición 2016
- EN 16615 Antisépticos y desinfectantes químicos. Método de ensayo cuantitativo para la evaluación de la actividad bactericida y levuricida en superficies no porosas empleando acción mecánica con toallitas en el área médica (4- ensayo campo). Método de ensayo y requisitos (fase 2, etapa 2)
- Pharmaceutical and Healthcare Sciences Society (PHSS), monografía técnica n.º 20 Bio-Contamination characterisation, control, monitoring and deviation management in controlled / GMP classified areas
- Centro para el Control y la Prevención de Enfermedades (CDC) Guía para la desinfección y la esterilización en establecimientos de atención médica (2008)
- Product Performance Test Guideline, OCSPP 810.2000, General Considerations for Testing Public Health Antimicrobial Pesticides, Guidance for Efficacy Testing, [EPA 712-C-17-002]
- Parenteral Drug Association (PDA) Technical Report No. 70. The Fundamentals of Cleaning and Disinfection Programs for Aseptic Manufacturing Facilities (2015).
- Pharmig Guide to Disinfectants and their use in the Pharmaceutical Industry (2017)
- West AM, Teska, PJ, Oliver HF; There is no additional bactericidal efficacy of Environmental Protection Agency registered disinfectant towelettes after surface drying or beyond label contact time. Am J Infect Control 2019; 47: 27-32



